Datos personales

- QUIMICA II
- ALONDRA ANGELES GERMAN ; LIDIA REYES MARQUEZ ; GABINO YAEL LUNA SUÑIGA
martes, 10 de abril de 2012
jueves, 5 de abril de 2012
NOMENCLATURA
NOMENCLATURA
En un sentido amplio, nomenclatura química son las reglas y regulaciones que rigen la designación (la identificación o el nombre) de las sustancias químicas.
Como punto inicial para su estudio es necesario distinguir primero entre compuestos orgánicos e inorgánicos.
Los compuestos orgánicos son los que contienen carbono, comúnmente enlazado con hidrógeno, oxígeno, boro, nitrógeno, azufre y algunos halógenos. El resto de los compuestos se clasifican como compuestos inorgánicos. Éstos se nombran según las reglas establecidas por la IUPAC.
Nomenclatura en química inorgánica
Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo.
Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades característica de la función ácido, debido a que todos ellos tienen el ion H+1; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas
Debemos recordar aquí que las principales funciones químicas son: óxidos, bases, ácidos y sales.
El sistema para nombrar actualmente los compuestos orgánicos, conocido como sistema IUPAC, se basa en una serie de reglas muy sencillas que permiten nombrar cualquier compuesto orgánico a partir de su fórmula desarrollada, o viceversa. Esta es la nomenclatura sistemática. Además existe la nomenclatura vulgar, que era el nombre por el que se conocían inicialmente muchas moléculas orgánicas (como por ejemplo ácido acético, formaldehído, estireno, colesterol, etcétera), y que hoy día está aceptada.
El nombre sistemático está formado por un prefijo, que indica el número de átomos de carbono que contiene la molécula, y un sufijo, que indica la clase de compuesto orgánico de que se trata.
Algunos de los prefijos más utilizados son:
| Átomos de C | Prefijo |
1
|
Met-
|
2
|
Et-
|
3
|
Prop-
|
4
|
But-
|
5
|
Pent-
|
6
|
Hex-
|
7
|
Hept-
|
8
|
Oct-
|
9
|
Non-
|
10
|
Dec-
|
 Ahora veremos como se nombran las distintas familias de compuestos orgánicos.
Ahora veremos como se nombran las distintas familias de compuestos orgánicos.En aquellos casos en los que se conozca el nombre vulgar, se incluirá al lado del nombre sistemático.
Hidrocarburos
Son aquellos compuestos orgánicos que contienen únicamente carbono (C) e hidrógeno (H) en su molécula.
Existen dos grupos principales de hidrocarburos, los alifáticos y los aromáticos, cada uno de los cuales se subdividen a su vez en varias clases de compuestos:
• Alifáticos: Dentro de este grupo están los alcanos, alquenos, alquinos y cicloalcanos
• Aromáticos: Existen dos clases de compuestos, los monocíclicos o mononucleares, que contienen sólo un núcleo bencénico y los policíclicos o polinucleares que contienen dos o más núcleos bencénicos.
Alcanos. Responden a la fórmula general CnH2n+2. Son hidrocarburos acíclicos (no tienen ciclos en su cadena) saturados (tienen el máximo número de hidrógenos posible).
- Alcanos de cadena lineal. Se nombran utilizando uno de los prefijos de la tabla anterior seguido del sufijo -ano.
Ejemplos:
| CH4 | metano |
| C2H6 | etano |
| C3H8 | propano |
| C4H10 | butano |
| C5H12 | pentano |
| C6H14 | hexano |
 Alcanos de cadena ramificada. Para nombrar estos compuestos hay que seguir los siguientes pasos:
Alcanos de cadena ramificada. Para nombrar estos compuestos hay que seguir los siguientes pasos:Buscar la cadena hidrocarbonada más larga y ésta constituye el hidrocarburo principal, que nombra al compuesto y que llevará la terminación -ano si es un alcano. Si hay más de una cadena con la misma longitud se elige como principal aquella que tiene mayor número de cadenas laterales.
Se numeran los átomos de carbono empezando por el extremo más próximo a un carbono con sustituyentes (radicales) y éstos se nombran anteponiéndoles un número localizador que indica su posición en la cadena, seguido de un guión.
Si existen dos sustituyentes en el mismo átomo de carbono, se repite el número separado por una coma. Cuando hay dos o más sustituyentes diferentes en el compuesto se nombran por orden alfabético. Por ejemplo 4,5-dietil-2,2,7-trimetildecano.
Para ver más sobre alcanos, ir a Nomenclatura y numeración de cadenas.
Alquenos y alquinos
Para nombrar los alquenos o los alquinos se toma como cadena principal la más larga que contenga el doble o triple enlace y se termina en -eno o -ino; su posición se indica con el número localizador más bajo posible y tiene preferencia sobre las cadenas laterales al numerar los carbonos.
Otros compuestos
Los alcoholes se nombran añadiendo la terminación -ol al hidrocarburo e indicando con el localizador más bajo posible la posición que ocupa el grupo -OH.
En los aldehídos se sustituye la terminación -o de los hidrocarburos por -al y la cadena se comienza a numerar por el extremo que lleva el grupo carbonilo (C=O).
Las cetonas se nombran cambiando la terminación -o del hidrocarburo por -ona, y la posición del grupo carbonilo se indica con un localizador.
En los ácidos carboxílicos se antepone la palabra ácido a la del hidrocarburo del que proceden, en el que la terminación -o se sustituye por -oico.
Las aminas se nombran añadiendo al nombre del radical el sufijo -amina. Si un mismo radical está repetido dos o tres veces se le anteponen los prefijos di- o tri-. Si la amina lleva radicales diferentes se nombran por orden alfabético.
Las amidas cambian la terminación -oico del ácido por el sufijo -amida.
Los nitrilos se pueden considerar derivados del cianuro de hidrógeno, H-CN, al sustituir el átomo de hidrógeno por radicales alquilo. Se nombran añadiendo el sufijo -nitrilo al nombre de la cadena principal.
ALQUINOS
Son hidrocarburos de cadena abierta que se caracterizan por
tener uno o más triples enlaces, carbono-carbono.
|
||||||||||||||||
En general su nomenclatura sigue las pautas indicadas para
los alquenos, pero
terminando en "-ino".
Es interesante la nomenclatura de los hidrocarburos que contienen dobles y triples
enlaces en su molécula.
|
||||||||||||||||
|
ALQUENOS
ALQUENOS
Son hidrocarburos de cadena abierta que se caracterizan por
tener uno o más dobles enlaces, C=C.
|
||||||
Se nombran igual que los alcanos, pero
con la terminación en
"-eno". De todas formas, hay que seguir
las siguientes reglas:
|
OXIDO REDUCCION
Óxido - Reducción
Reacciones de óxido reducción o redox: Son aquellas reacciones en las cuales los átomos experimentan cambios del número de oxidación. En ellas hay transferencia de electrones y el proceso de oxidación y reducción se presentan simultáneamente, un átomo se oxida y otro se reduce. En estas reacciones la cantidad de electrones perdidos es igual a la cantidad de electrones ganados.
Número de oxidación o estado de oxidación: es el número que se asigna a cada tipo de átomo de un elemento, un compuesto o ión, y que representa el número de electrones que ha ganado, perdido o compartido. El número se establece de manera arbitraria, pero su asignación se basa en diferentes postulados
Existen diferentes definiciones sobre oxidación y reducción:
Oxidación: es un incremento algebraico del número de oxidación y corresponde a la perdida de electrones. También se denomina oxidación la pérdida de hidrógeno o ganancia de oxígeno.
Reducción: es la disminución algebraica del número de oxidación y corresponde a la ganancia de electrones. Igualmente se define como la pérdida de oxígeno y ganancia de hidrógeno.
Para determinar cuando un elemento se oxida o se reduce puede utilizarse la siguiente regla práctica:
Si el elemento cambia su número de oxidación en este sentido
Si el elemento cambia su número de oxidación en este sentido
Agentes reductores: son especies químicas que pierden electrones, se oxidan y reducen a otras sustancias.
Reglas para asignar el número de oxidación: El uso de los números de oxidación parte del principio de que en toda fórmula química la suma algebraica de los números de oxidación debe ser igual a cero. Basado en esto se han creado las siguientes reglas:
Los elementos no combinados, en forma de átomos o moléculas tienen un número de oxidación igual a cero. Por ejemplo:
El hidrógeno en los compuestos de los cuales forma parte, tiene como número de oxidación +1:
En los hidruros metálicos el número de oxidación es -1.
Cuando hay oxigeno presente en un compuesto o ion, el numero de oxidación es de -2:
En los peróxidos el numero de oxidación del oxigeno es -1: H2O2-1
El oxigeno tiene numero de oxidación +2 en el F2O porque el F es mas electronegativo que el oxigeno.
El número de oxidación de cualquier ion monoatómico es igual a su carga. Por ejemplo:
Los no metales tienen números de oxidación negativos cuando están combinados con el hidrogeno o con metales:
Los números de oxidación de los no metales pasan a ser positivos cuando se combinan con el oxigeno, excepto en los peróxidos.
Pasos para establecer el numero de oxidación:
Paso 1: Anotar encima de la formula los números de oxidación de aquellos elementos con números de oxidación fijo. Al elemento cuyo índice de oxidación se va a determinar se le asigna el valor de X y sumando éstos términos se iguala a 0. Esto permite crear una ecuación con una incognita.
Paso 2: Multiplicar los subíndices por los números de oxidación conocidos:
Paso 3: Sustituir en la fórmula química los átomos por los valores obtenidos e igualar la suma a 0, luego despejar X y calcular el valor para ésta. El valor obtenido para X será el número de oxidación del Nitrógeno en el ácido nítrico: La suma algebraica de los números de oxidación debe ser igual a 0.
El mismo procedimiento se aplicará en el caso de los iones, con la salvedad que la suma algebraica debe tener como resultado el número de carga del ión. Así para calcular el número de oxidación del Cl en el ión clorato (ClO-3), la ecuación será igual a menos 1 (-1).
Paso 1: Aquí es importante recordar que el número de oxidación del Oxígeno en un compuesto o ión es de -2, excepto en los peróxidos donde es -1.
Paso 2: El número de oxidación del cloro en el ión clorato es +5
Oxidación y reducción en una ecuación: para determinar si un elemento se oxida (agente reductor) o se reduce (agente oxidante) en la ecuación pueden seguirse los siguientes pasos:
Paso 1: Escribir los números de oxidación de cada elemento:
Paso 2: Se observa que los elementos varían su número de oxidación:
Paso 3: Determinación de los agentes reductores y oxidantes:
Balanceo de ecuaciones de óxido reducción (Redox): Las reacciones de óxido-reducción comprenden la transferencia de electrones. Pueden ocurrir con sustancias puras o con sustancias en solución. Para balancear una ecuación redox, generalmente se usan dos métodos; el método de ión electrón o de las semiecuaciones utilizado para las ecuaciones iónicas y el método del cambio en el número de oxidación que se puede usar tanto en ecuaciones iónicas como en ecuaciones totales (moleculares).
Método del ión electrón:
Para balancear la siguiente ecuación:
Paso 1: Escribir la ecuación parcial para el agente oxidante y otra para el reductor:
Paso 2: Igualar cada ecuación parcial en cuanto al número de átomos de cada elemento. Para ello puede añadirse H2O y H+ a las soluciones ácidas o neutras, esto para conseguir el balanceo de los átomos de oxígeno e hidrógeno. Si se trata de soluciones alcalinas puede utilizarse el OH-. Así: Esta ecuación parcial requiere que se coloque un 2 en el Cr de la derecha para igualar la cantidad de la izquierda, además requiere de 7H2O en la derecha para igualar los oxígenos de la izquierda (O-27). Es por ello que para igualar los hidrógenos del agua se coloca 14H+ en la izquierda.
Paso 3: Efectuar el balanceo de las cargas:En esta ecuación la carga neta del lado izquierdo es 12+ y del lado derecho es 6+, por ello deben añadirse 6 electrones (e-) en el lado izquierdo:
Para la ecuación parcial:
Para la ecuación parcial:
Fe+2
Se suma 1 e- del lado derecho para igualar la carga 2+ en el lado izquierdo, quedando:
Paso 4:
Ahora se igualan los electrones ganados y perdidos, para ello se multiplica la ecuación:
Fe+2
Ahora se igualan los electrones ganados y perdidos, para ello se multiplica la ecuación:
Fe+2
Paso 5: Se suman las ecuaciones parciales y se realiza la simplificación de los electrones:
Para comprobar que la ecuación final está balanceada, se verifican tanto el número de átomos como el número de cargas:
Balance atómico
Balance electrolítico
Izquierda
Derecha
Izquierda = Derecha
2Cr
2Cr
-2+14+12 = 6 + 0 + 18
+24 = 24
+24 = 24
70
70
14H
7x2 =14H
6Fe
6Fe
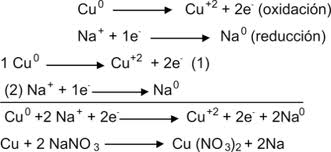
Método del cambio de valencia:
Balanceo de la siguiente ecuación:
Paso 1: Escribir el número de oxidación de cada elemento siguiendo las reglas tratadas en este tema para asignar el número de oxidación.
Paso 2: Determinar cuales elementos han sufrido variación en el número de oxidación:
Paso 3: Determinar el elemento que se oxida y el que se reduce:
Paso 4: Igualar el número de electrones ganados y perdidos, lo cual se logra multiplicando la ecuación
Sn0 – 4e-
Sn0 – 4e-
Paso 5:
Sumar las dos ecuaciones parciales y simplificar el numero de electrones perdidos y ganados que debe ser igual:
Sumar las dos ecuaciones parciales y simplificar el numero de electrones perdidos y ganados que debe ser igual:
Paso 6: Llevar los coeficientes de cada especie química a la ecuación original:
En algunos casos la ecuación queda balanceada pero en otros, como este es necesario terminar el balanceo por tanteo para ello es necesario multiplicar el agua por dos:
En algunos casos la ecuación queda balanceada pero en otros, como este es necesario terminar el balanceo por tanteo para ello es necesario multiplicar el agua por dos:
Balance atómico
1 Sn
1 Sn
4 H
2 x 2 = 4 H
4 N
4 N
4 x 3 = 120
2 + (4x2) + 2 = 120
Suscribirse a:
Entradas (Atom)